近日,探花porn 柔性电子全国重点实验室汪联辉教授团队在自递送纳米药物领域取得新进展。相关成果以“Self-Delivery Nanomedicine for Selective Mitochondrial Copper Depletion and Oxidative Stress Amplification”为题发表在国际学术期刊Acs Nano上。重点实验室汪联辉教授、万双双副教授及山东第一医科大学陈嘉副教授为共同通讯作者,青年教师陶俊和硕士生宁维青为论文共同第一作者。
三阴性乳腺癌(TNBC)因不表达雌激素受体、孕激素受体及人表皮生长因子受体,被认为是临床治疗难度极高的恶性肿瘤。调控细胞内氧化应激水平以升高活性氧(ROS)浓度,进而诱导TNBC细胞凋亡,是TNBC有效的治疗策略之一。为最大化发挥 ROS的抗肿瘤功效、避免其在细胞质中弥散流失,常将ROS靶向递送至细胞的能量代谢工厂—线粒体,通过破坏线粒体内源性氧化还原平衡,引发线粒体损伤并最终触发细胞凋亡。然而,TNBC具备强大的适应性防御机制,可通过多种途径主动减轻线粒体氧化损伤、抑制凋亡进程:一方面,线粒体自身存在高效抗氧化系统,如谷胱甘肽代谢通路可显著清除过量ROS;另一方面,TNBC细胞还能借助线粒体融合、裂变或自噬等动态调控机制,及时清除受损线粒体、维持线粒体功能稳态。因此,通过协同调控线粒体相关信号通路,在阻断其修复机制的同时进一步增强线粒体氧化应激,有望成为提升TNBC治疗疗效、抑制肿瘤转移的关键策略。
针对上述问题,该团队开发了一种选择性耗竭线粒体铜离子的有机小分子CDM,将其与DSPE-)PEG2000-COOH协同组装制备得到自递送纳米药物(CDM NPs)。CDM NPs可快速汇集在肿瘤组织内、精准靶向细胞线粒体、耗竭线粒体铜离子,高效诱导线粒体功能障碍;激光照射后,产生大量的ROS,放大细胞氧化应激,并通过免疫原性细胞死亡有效抑制肿瘤生长,逆转免疫抑制微环境。
该研究得到了国家自然科学基金、江苏省自然科学基金、有机电子与信息显示国家重点实验室主任基金等项目的支持。论文链接://pubs.acs.org/doi/abs/10.1021/acsnano.5c11565.
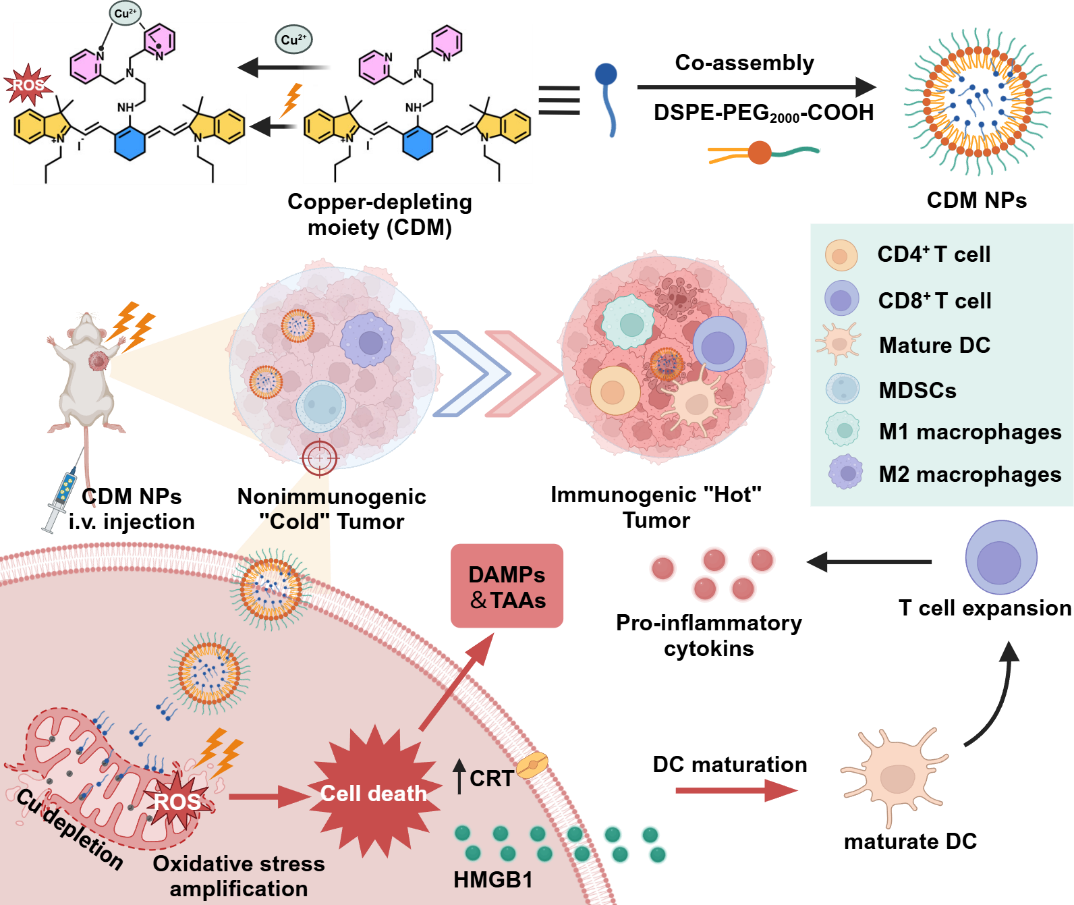
图:自递送纳米药物的合成及其抗肿瘤治疗示意图
(撰稿:陶俊 编辑:陈宁娜 审核:凌海峰)


